氧化還原反應

日常生活中,我們所接觸的許多事物都涉及氧化還原反應,例如:鐵的銹蝕、光合作用、電池與電解等。氧化與還原必定伴隨發生,氧化還原的定義如表。

電子的轉移可以說是氧化還原反應的重要依據,1992年諾貝爾化學獎就是頒給美國加州理工學院的馬庫斯(RudolphA. Marcus,1923-)教授。他提出了溶液中電子轉移理論,解釋氧化還原反應速率與反應自由能、溶劑及化合物結構的關係,使得後來的化學家能準確預測反應速率。
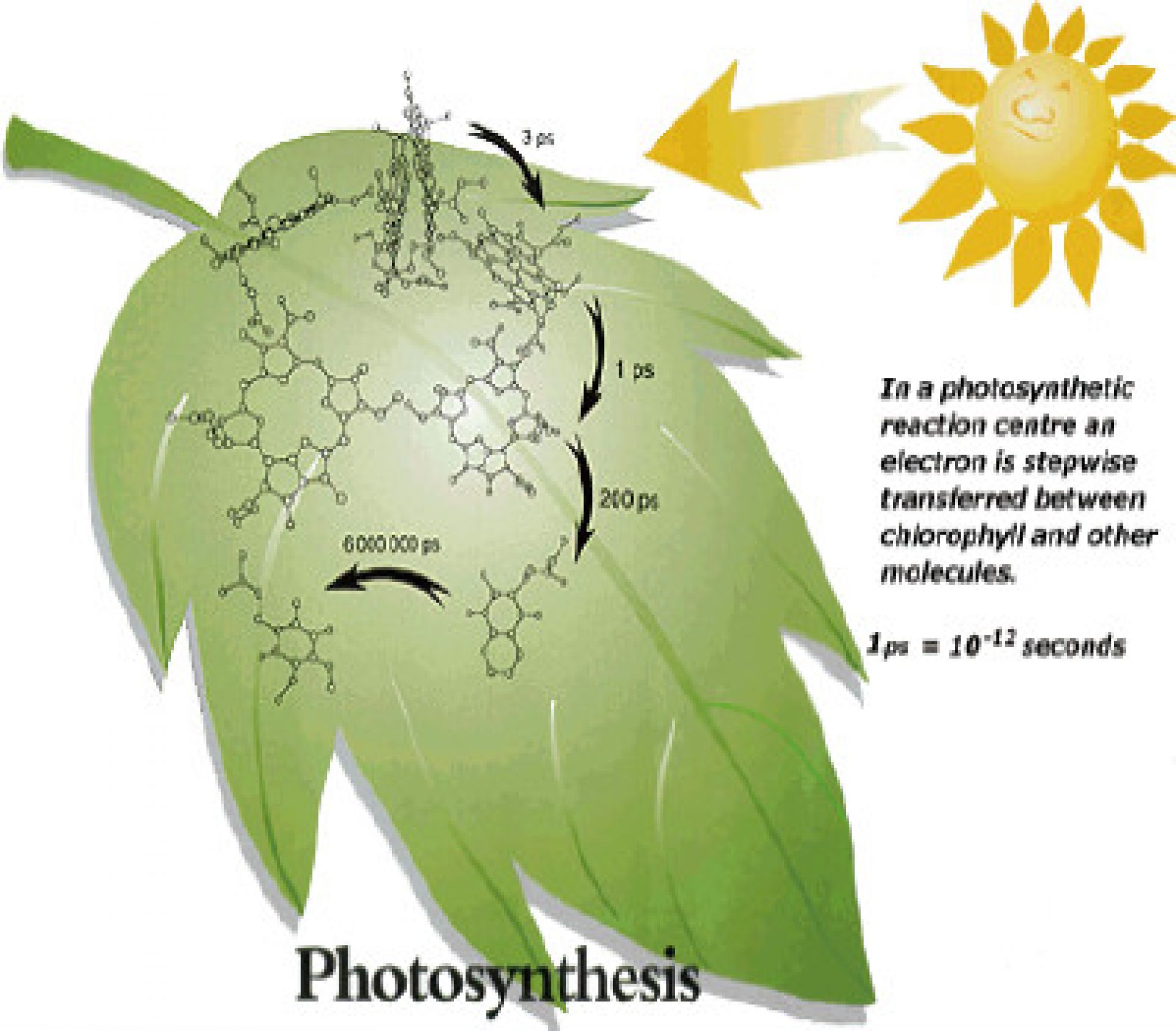
植物利用光合作用將水和二氧化碳轉換為高能的化合物(醣類),事實上,光合作用並不是一個步驟,它包含兩個過程而每一個過程又包含許多步驟,光合作用已知的兩個過程分別為光反應和卡文循環 (Calvin cycle,暗反應)。決定性的反應在細胞的反應中心發生,當入射光照射時,會依特定路徑至一對的葉綠素(chlorophyll)分子(如左圖),在這些分子內電子會被提昇至較高能階並一步步地傳遞(圖中的箭頭指示),重要的是第一個傳遞跳躍的電子必須是非常快速的,從葉綠素轉移到反應中心而發生的時間為一個pico 秒左右,否則電子將會回復至基態;最後電子發現自己在一個相對地穩定狀態且具有足夠能量去實行有機體所需的化學能。
註:光合作用的過程繁瑣,目前有許多的化學家和生物學家利用雷射等儀器探究光反應過程,也有人研發於太陽能發電上,本文主要目的為介紹氧化還原觀念。