滲透壓

「滲透壓」(Osmotic pressure)是指當兩種濃度不同的溶液被半透膜隔開時,為了阻止水分子從低濃度溶液向高濃度溶液擴散(即滲透),所需要施加在高濃度溶液上的壓力。這個現象是溶液的一種依數性質(colligative property),只與溶質粒子的數量有關,而與其性質無關。
✅ 滲透壓的基本原理
- 半透膜:只允許水(溶劑)通過,不允許溶質(如鹽、糖)通過;溶劑會由低濃度流向高濃度
- 如果你要阻止這種水的流動,就需要在高濃度那一側施加壓力,這個壓力就是滲透壓。
🧪 滲透壓公式(范特荷夫公式):
1887年凡特荷夫(van't Hoff)由實驗證明:稀薄溶液之滲透壓與體積莫耳濃度和絕對溫度成正比,稱為凡特荷夫方程式。
當溶質為非電解質時:
🔬小實驗驗證
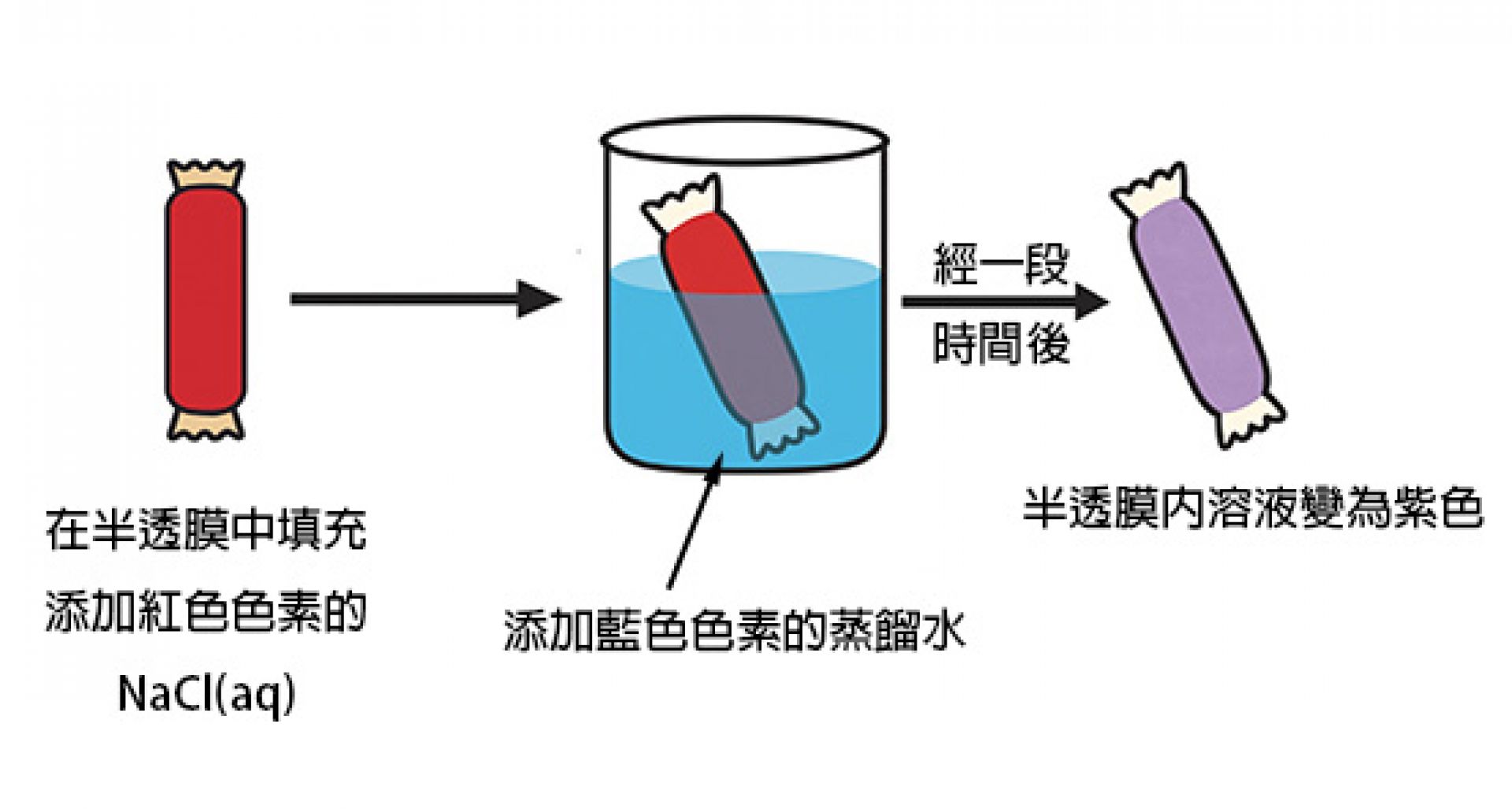
取一半透膜填充0.1M混有紅色色素的食鹽水,將其封閉後置於裝有添加藍色色素的蒸餾水中,經一段時間後取出半透膜,發現半透膜內溶液變紫色,可以證明燒杯的水滲透進入半透膜內。
🧬 舉例應用
〇人體細胞與靜脈注射液:生理食鹽水(0.9% NaCl)與血液等張,能防止紅血球膨脹或收縮。
〇植物吸水:根據滲透壓原理,植物根部能吸收土壤中的水分,使得植物生長。
〇海水淡化:利用逆滲透(reverse osmosis)技術,施加壓力將水由高濃度的海水變為淡水。